发布日期:2020-11-07 发布人:润达生物
肠道微生物失调广泛意义是与宿主疾病或失调相关的肠道微生物群落组成的各种状态。在健康的肠道环境中,肠道内细菌是非致病性的。
我们对营养作为健康和疾病中介的理解大部分是透过对饮食和肠道微生物群之间关系得到的。西方饮食对肠道微生物失调的影响众所周知。这一研究构建明显的缺点就是少了对肠道病毒体的基本了解,人们很早就知道,病毒带有抗生素耐药基因和细菌毒素,诱导临床相关病原菌的毒性及传播。越来越多的证据表明肠道病毒的改变与结直肠癌、炎症性肠病和其他微生物失调状态相关。肠道中病毒的作用,是肠道微生物失调的原因还是后果,目前尚不清楚。
01
肠道微生物失调
肠道微生物失调广泛意义是与宿主疾病或失调相关的肠道微生物群落组成的各种状态。在健康的肠道环境中,肠道内细菌是非致病性的。健康的肠道菌群与宿主是一种共生关系,其中肠道细菌在宿主的胃肠环境中茁壮成长,同时通过代谢、免疫系统发育和免受病原体的侵害为宿主提供多种益处。当微生物失调时,这种共生的动态平衡发生变化,原本有益的肠道共生菌可以转变为致病菌。许多临床疾病的病因都与微生物失调有关,如炎症性肠病、非酒精性脂肪肝,动脉粥样硬化和自闭症。
02
肠道病毒
肠道病毒的主要成员是噬菌体。肠道细菌可以通过16srRNA基因测序,但是这种方法对于噬菌体是不可能的,因为它们缺乏保守的系统演化标记。即使是研究噬菌体的金标准–病毒元基因组学,也受到缺乏基因组资料库的限制,无法与未定性噬菌体基因的巨大多样性进行比较。肠道噬菌体研究进展已经证明了噬菌体在肠道微生物中作为组成改变因子的作用。噬菌体通过裂解细菌宿主或介导基因转移,对微生物群落施加进化压力。在肠道中,噬菌体主要是温和型的,能够将自己的基因整合到宿主细菌染色体中,成为前噬菌体, 从而潜伏在细菌宿主一起繁殖;然后,前噬菌体可以通过诱导裂解循环来产生噬菌体后代(图1)。温和噬菌体也可以选择通过直接进入裂解循环并立即裂解它们的细菌宿主来繁殖。在GenBank数据库中,大约一半全基因组测序过的细菌包含至少一个前噬菌体,有些细菌可以容纳多达15个前噬菌体。前噬菌体与细菌的弹性和功能密切相关,编码新陈代谢、抗生素耐药性和毒素产生的基因,从而为细菌宿主提供健康益处。通过阻止其他噬菌体的感染和裂解竞争细菌,前噬菌体进一步增强了其细菌宿主的适合性。细菌与其宿主形成共生关系需要一些噬菌体编码的基因。相反,噬菌体编码的毒力因子促进其宿主的致病行为。这些发现与肠道微生物失调的研究高度相关。
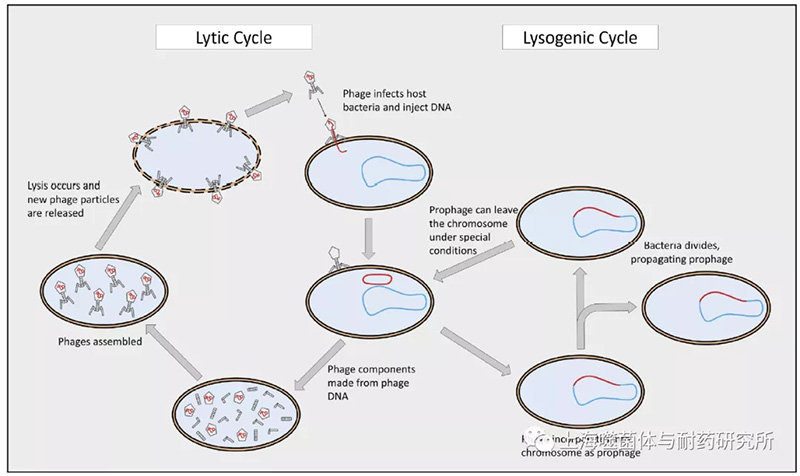
图1 温和噬菌体繁殖生命周期
03
噬菌体在生物失调中的作用
生物失调与粘膜温和噬菌体种群的丰度增加有关。在适度的基线水平下,肠内的噬菌体被自发地诱导进入裂解周期。大规模诱导通常需要环境压力源,该环境压力源会在细菌宿主中引起“ SOS反应”,SOS反应是由细菌染色体中的DNA损伤触发。肠道炎症与常驻肠道细菌中的SOS反应上调、噬菌体多样性的丧失以及前噬菌体诱导水平升高有关。已经发现通过扩大噬菌体编码基因的毒力因子和抗生素抗性库,可以驱动细菌病原体的进化。在肠道病原体感染下,触发SOS反应的抗生素通过噬菌体诱导途径激活志贺毒素的合成,可能会导致腹泻、出血性结肠炎、溶血性尿毒症甚至死亡。前噬菌体编码其他临床相关病原体的毒力因子,包括霍乱弧菌、金黄色葡萄球菌、白喉棒状杆菌和肉毒梭菌,除了直接编码毒素基因外,还可以间接上调细菌毒素的产生并影响粘附、定植和侵袭。此外,粪菌移植艰难梭菌菌群失调的恢复与供体噬菌体的摄取有关。总而言之,各种强有力的证据表明,肠道噬菌体在肠道微生物失调相关的疾病中发挥着作用。
04
西方饮食失调个案研究
关于西方饮食的大量文献为该理论模型提供了理想的案例研究,表明噬菌体在介导生物失调中的潜在作用(图2)。“西方”饮食通常被概括为“高脂肪”,在西方饮食诱导的肥胖小鼠模型中,不良反应有葡萄糖耐量不全和脂肪肝,用诺氟沙星和氨苄西林治疗后,两者均可改善。西方饮食会破坏肠道微生物动态平衡,从而激发肠道通透性增加,内毒素吸收增加和内毒素血症的状态。内毒素继而驱动宿主的免疫反应,从而产生炎症、葡萄糖耐受不良和代谢综合征等其他症状。
西方饮食不仅摄入过多的脂肪,而且纤维素摄入低,所以肠道菌群从上皮粘液层中觅食多糖来进行补偿。健康的粘液层将敏感的宿主上皮与肠腔的促炎成分分开。然而,聚糖觅食细菌降解粘液层会削弱这种保护作用,使腔内细菌更靠近上皮,从而促进炎症并增加肠道通透性。据推测,肠壁的通透性变高,会允许更多的氧气从血流进入正常缺氧的肠腔,从而对肠道专性厌氧菌造成氧化应激。在小鼠结肠炎模型中,氧气呼吸成为主要的代谢信号,这一发现支持了这一观点。肠道细菌群落的组成是放射状的,与黏膜相关的细菌最耐氧。并且肠屏障存在一定程度的通透性,与细菌易位和免疫激活相关的通透性增加是有害的,并导致慢性炎症的发生。氧浓度的变化也可能会影响肠道噬菌体的数量,因为氧化应激是SOS反应的触发因素,并且可以诱导噬菌体进入裂解周期。
研究发现,西方饮食可以增加肠道粘膜中噬菌体的种群密度,并扩大噬菌体繁殖所需的噬菌体编码基因库。温和的噬菌体感染率较高,可通过破坏细菌基因的功能而引起共生细菌的致病性,即引起肠道菌群失调。由于西方饮食对肠道环境的干扰上调了噬菌体编码的脂质代谢和氧化耐受基因,因此可以合理地推测,在脂质利用率更高、氧水平更高的肠道环境中,这些噬菌体可能会赋予其细菌宿主竞争优势。
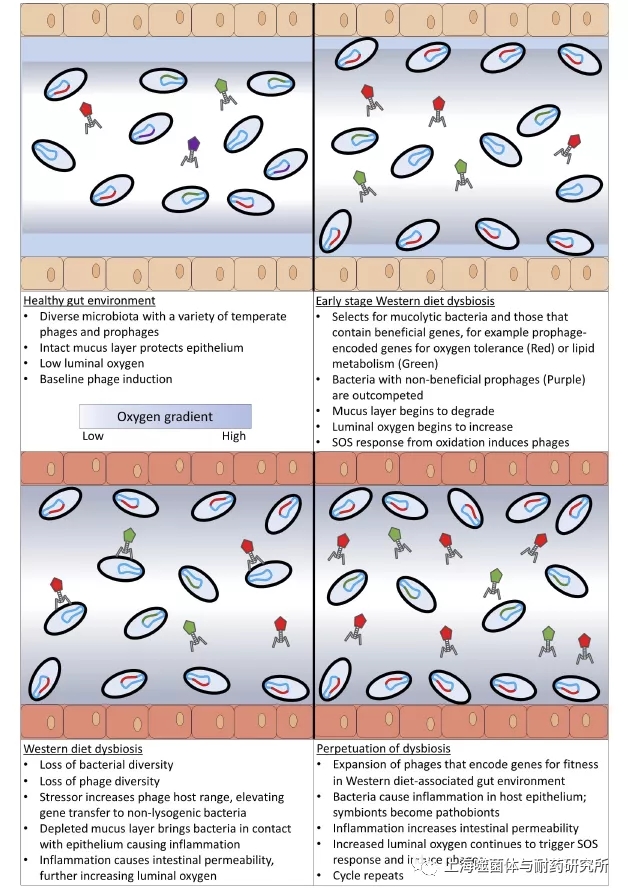
图2 噬菌体用于生物失调的理论模型
展望
粪菌移植临床治疗的最新进展表明,艰难梭菌感染的成功治疗与粪菌移植接受者对供体粪便噬菌体的吸收存在关联。一项临床研究发现,给予去除细菌的粪便滤液足以治疗艰难梭菌感染,并使受体噬菌体群落向供体噬菌体转变。在溃疡性结肠炎小鼠模型中,与无反应组相比,粪菌移植作用者的粘膜噬菌体数量减少。供体噬菌体群落的组成尚未被认为是影响粪菌移植的重要因素。并且,接受者的饮食因素也没有被考虑到。肠道噬菌体在很大程度上影响肠道微生物的组成,进而影响肠道微生物与人类宿主的关系。肠道噬菌体非常有趣,仍然需要进行大量的研究[1]。
参考文献
Lin, D.M. and H.C. Lin, A theoretical model of temperate phages as mediators of gut microbiome dysbiosis. F1000Res, 2019. 8.
文章来源:上海噬菌体与耐药研究所,戴佳